
pHと酸性・アルカリ性・中性の関係~pHの意味と水溶液の液性とは?
pH(英語でピーエイチ、ドイツ語でペーハー)は水溶液に含まれる「水素イオン」の濃度で、濃度が濃い水溶液の液性を「酸性」、薄いと「アルカリ性」と呼びます。濃度を数字で表現しますから、酸性・アルカリ性の強さが数字でわかります。
pHが変わると色も変わる化学薬品が指示薬で、ひとめで液性を知るためには便利です。受験対策としては、指示薬の名前と色の変化を完全に覚えなければなりません。1つでも「うろ覚え」の部分があると、「いもづる式」に間違えてしまうからです。
「pH」「イオン」の細かな定義や、水溶液のpH値を覚える必要はありません。前半でpHと水溶液の液性に関する常識的な知識を整理してから、後半ではのちに学習する中和と関係する内容を解説します。
Contents [hide]
pHと酸性・アルカリ性・中性~水溶液の液性との関係とは?
pHの値は「ゼロ」から「14」まであり、「7」が中性、「7」より小さいと酸性、「7」より大きいとアルカリ性です。pHが「7」から「ゼロ」に近づくほど、強い酸性となります。
pHと水溶液の液性を、具体的に見てみましょう。
pHと酸性・アルカリ性・中性~真ん中より左が酸性、右がアルカリ性!
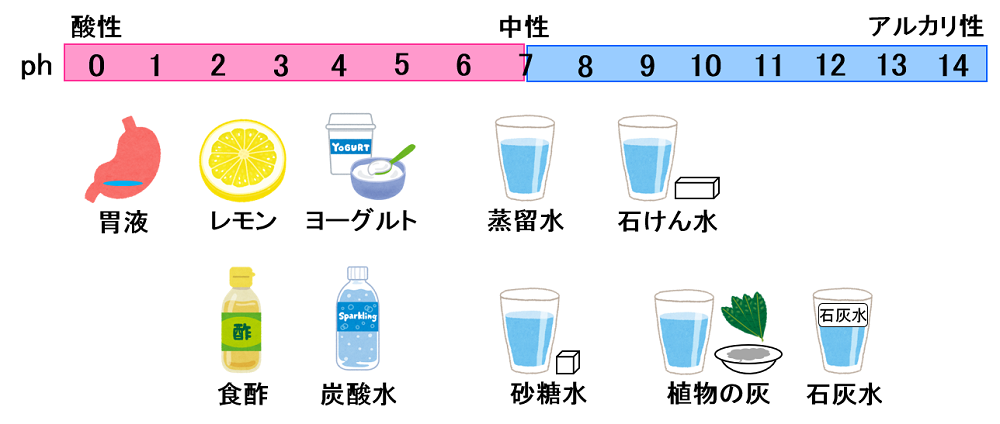
数字を覚える必要はありませんが、pHの値を左から右に大きくなるように並べたとき、ちょうど真ん中(pH値は「7」)が中性です。左側が酸性で左にいくほど酸性は強く、右側はアルカリ性で右にいくほどアルカリ性は強くなっていきます。
pH値が小さいほど「水素イオン」の濃度が濃いので、矛盾していると感じるかもしれませんが、理由は小学で学ぶ範囲を大きく超えてしまうので省略します。
pH値を横に並べると左が酸性、右がアルカリ性という知識は、常識というよりも「指示薬の色の変化」を覚えるために便利な知識ですから、必ず覚えるべきです。
純粋な水は中性ですが、厳密には冒頭で述べた「水素イオン」がごく微量ながら含まれます。これについて詳しくは、後半で解説します。なお水に物質が溶けたものを水溶液と呼びますので、蒸留水は水溶液ではありません。
pHと酸性・アルカリ性・中性~なめて酸っぱい=酸性、は間違い!?
酸性の水溶液は、「なめると酸(す)っぱい」という特徴があります。実際酸性の水溶液の名前には「酸」という文字が含まれるので、非常にわかりやすい液性です。ただ1つ「水酸化ナトリウム水溶液」だけは「酸」を含んでいるのにアルカリ性となりますが、この水溶液を酸性と間違える受験生はいないでしょう。
アルカリ性の水溶液は、「なめると苦いまたは渋い」という特徴があります。というよりも、普通なめようと思わないものをアルカリ性の水溶液と考えればいいでしょう。
中性の水溶液は味もさまざまで、砂糖水は甘く、塩水はしょっぱいです。アルカリ性の水溶液と違って、こちらは日常生活の中でなめる機会があるという違いがあります。
なめて液性がわかるなら指示薬などいらないだろう、と思われるかもしれません。例えば酸性の食酢に中性の砂糖水を加えると、酸性でありながら酸っぱさを感じなくなります。ですから、味だけで液性を判断することはできませんし、そもそも劇薬もあるのですから何でもなめてみるというわけにもいきません。
pHと酸性・アルカリ性・中性~水溶液の中で起きている現象とは?
これから解説する内容は、pHの意味を理解するというよりも、のちに「中和」を学習するために必要な知識となりますので、雰囲気に慣れるつもりで読み進めてください。
pHと酸性・アルカリ性・中性~液性の正体(その1)
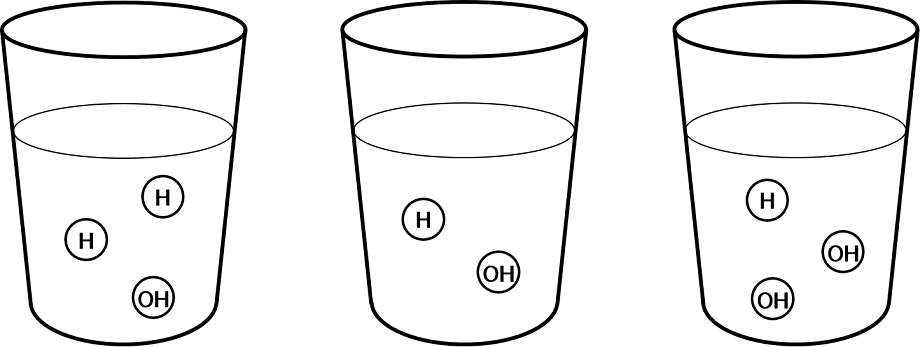
上図で「H」は水素、「O」は酸素を示し、「OH」は水素と酸素が合わさった「水酸基」と呼ばれます。実は水の中では電気を帯びた「イオン」という状態(「H+」と「OH-」)で存在し、水溶液の液性は水素イオン(H+)の濃度によって決まります。
のちの中和における学習では、イオンという考え方まで習得する必要がないため、図に電気的な性質は表現していません。
【補足】
pHは「power of Hydrogen ion concentration」の略で、日本語では「水素イオン指数」といいます。
真ん中の図で示すように、純粋な水もごく少量ながら
H2O → H+ + OH- という形で分離しているため、水素イオンを含みます。
図左は「H+」が「OH-」よりも多い酸性の状態、図の真ん中は「H+」と「OH-」が同数で中性の状態、図右は「H+」が「OH-」よりも少ないアルカリ性の状態を示しています。
pHと酸性・アルカリ性・中性~液性の正体(その2)
例えば塩酸は水(H2O)に塩化水素(HCl)が溶けているので、「H+」が多い状態となっています。また水酸化ナトリウム水溶液は水(H2O)に水酸化ナトリウム(NaOH)が溶けているので「H+」よりも「OH-」が多い状態です。前者が酸性、後者がアルカリ性の状態ということになります。
先ほどの図において、たとえば左図(「H」が2つ、「OH」が1つ)の水溶液と右図(「H」が1つ、「OH」が2つ)の水溶液を混ぜると、中和して中性の水(「H2O」が3つ)となります。
まとめ
◎ pHを左から右に大きくなるように並べたとき、真ん中より左が酸性で、真ん中より右がアルカリ性です。
◎ 基本的にはなめると酸(す)っぱいのが酸性、苦い(渋い)のがアルカリ性です。酸性の水溶液は名前に「酸」がつき、アルカリ性の水溶液をなめる気にはなれません。
◎ 「H」と「OH」の組み合わせパターンに、慣れておきましょう。
※記事の内容は執筆時点のものです
とじる
お気に入り機能は
会員の方のみご利用できます
会員登録のうえログインすると
お気に入り保存できるようになります。
お気に入りのコンテンツは、
マイページから確認できます

