
中和とは? 酸性とアルカリ性を混ぜる? 中性になるとは限らないので注意!
中和とは、「酸性の水溶液とアルカリ性の水溶液が混ざることによって、水と塩(えん)ができる化学反応」です。混ぜ合わせた水溶液の液性は、「アルカリ性」、「中性」、「酸性」のいずれかになります。中和によって中性になるとは限らないので注意が必要です。
以上をしっかりと理解することが中和の知識に関するすべてで、あとは計算問題の解き方を習得するだけです。逆に、少しでも理解にあやふやな部分があるなら、まだ計算問題に着手すべきではありません。どこかで必ず、ふりだしに戻ることになってしまうからです。
今回は、のちの計算問題を念頭において、モデルを使った中和の説明を行います。知識というよりも、計算問題を解くための準備運動と考えたほうが良いかもしれません。
なお、この記事に登場する「イオン」とは電気的な性質を持つ原子で、プラスイオンとマイナスイオンとがあります。ここでは、あまり深く考えこまず、そんなものだと割り切って、慣れてしまってください。場合によっては、プラスとマイナスの記号を無視していただいても結構です。
Contents [hide]
中和反応のようすを追いかけてみよう
中学受験で出題される中和の計算問題は、おもに酸性の水溶液として「塩酸」、アルカリ性の水溶液として「水酸化ナトリウム水溶液」が用いられます。水溶液に含まれる物質は、それぞれ「塩化水素」「水酸化ナトリウム」と「水」です。
まずは、これらの物質をつくる部品についての基礎知識を整理してから、具体的な中和のモデルについて説明していきます。
酸性とアルカリ性の水溶液をつくる部品
「塩化水素(HCl)」とは、「塩素(Cl)」と化合した「水素(H)」のことです。水に溶けると、「H+(水素イオン)」と「Cl-(塩素イオン)」という状態で水の中を漂います。
「水酸化ナトリウム(NaOH)」とは、「水素(H)」「酸素(O)」と化合した「ナトリウム(Na+)」のことです。水に溶けると、「Na+(ナトリウムイオン)」と「OH-(水酸化物イオン)」という状態で水の中を漂います。
水の中に「H+(水素イオン)」があれば酸性を示し、「OH-(水酸化物イオン)」があればアルカリ性を示します。両方あると、「H+(水素イオン)」と「OH-(水酸化物イオン)」は仲が良いので、すぐに結びついて中性の「H2O(水)」になります。
水の中で漂っている「Na+(ナトリウムイオン)」「Cl-(塩素イオン)」は、水がなくなると化合して固体の「NaCl(塩化ナトリウム=食塩)」となります。
逆に固体の食塩を水に溶かすと、「ナトリウムイオン」「塩素イオン」という状態で水の中を漂います。
中和とは~混ぜ合わせて「中性」になるモデルケース
図1:「中性」になるモデルケース
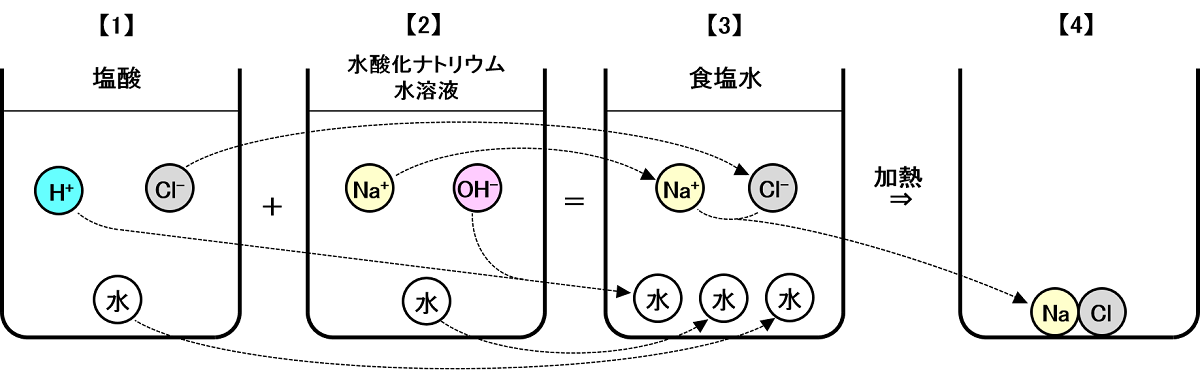
【1】の塩酸は、水に塩化水素(HCl)が1つ溶けたもので、中に含まれる物質は「H2O(水)」「H+(水素イオン)」「Cl-(塩素イオン)」です。
【2】の水酸化ナトリウム水溶液は、水に水酸化ナトリウム(NaOH)が1つ溶けたもので、中に含まれる物質は「H2O(水)」「Na+(ナトリウムイオン)」「OH-(水酸化物イオン)」です。
2つの水溶液を混ぜると、仲の良い「H+(水素イオン)」と「OH-(水酸化物イオン)」は結びついて中性の「H2O(水)」になります。混ぜ合わせた水溶液に含まれる物質は「H2O(水)×3」「Na+(ナトリウムイオン)」「Cl-(塩素イオン)」、つまり食塩水です【3】。
混ぜ合わせた水溶液には酸性を示す「H+(水素イオン)」もアルカリ性を示す「OH-(水酸化物イオン)」も存在せず、液性は中性です。
この水溶液を熱して水を蒸発させると、水の中を漂っていた「Na+(ナトリウムイオン)」と「Cl-(塩素イオン)」は化合して「NaCl(塩化ナトリウム=食塩)」となり、白い固体が残ります【4】。
このように酸性水溶液とアルカリ性水溶液が反応してできる水以外のものを、塩(えん)と呼びます。
中和とは~混ぜ合わせて「酸性」になるモデルケース
図2:「酸性」になるモデルケース
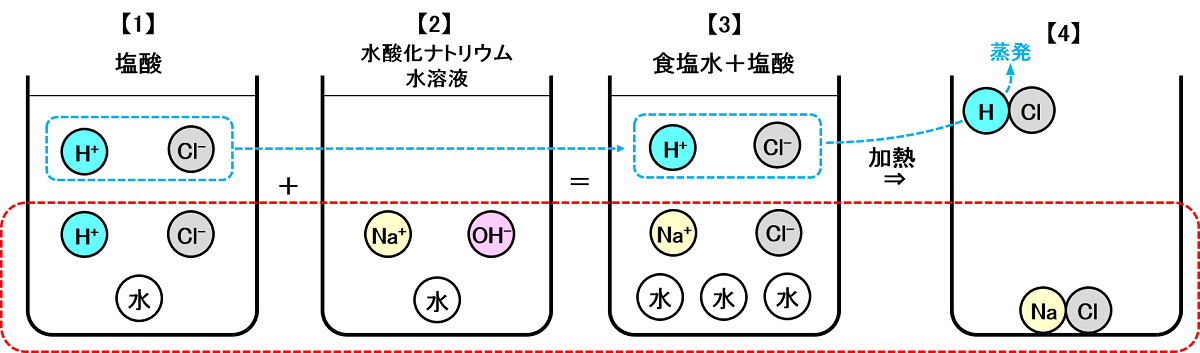
【1】の塩酸は、水に塩化水素(HCl)が2つ溶けたもので、中に含まれる物質は「H2O(水)」「H+(水素イオン)×2」「Cl-(塩素イオン)×2」です。
【2】の水酸化ナトリウム水溶液は、水に水酸化ナトリウム(NaOH)が1つ溶けたもので、中に含まれる物質は「H2O(水)」「Na+(ナトリウムイオン)」「OH-(水酸化物イオン)」です。
2つの水溶液を混ぜると、赤点線部分は<図1>と同じ反応がおこります。異なるのは青点線部分で、「H+(水素イオン)」「Cl-(塩素イオン)」が1つずつ余っている点です。つまり混ぜ合わせた水溶液は、「食塩水+塩酸」です【3】。
混ぜ合わせた水溶液には酸性を示す「H+(水素イオン)」が1つ存在するので、液性は酸性です【3】。
この水溶液を熱して水を蒸発させると、中にあった「Na+(ナトリウムイオン)」と「Cl-(塩素イオン)」は化合して「NaCl(塩化ナトリウム=食塩)となり、白い固体が残ります【4】。
余った「H+(水素イオン)」と「Cl-(塩素イオン)」は気体の「HCl(塩化水素)」となり、水とともに蒸発してしまいます【4】。
中和とは~混ぜ合わせて「アルカリ性」になるモデルケース
図3:「アルカリ性」になるモデルケース
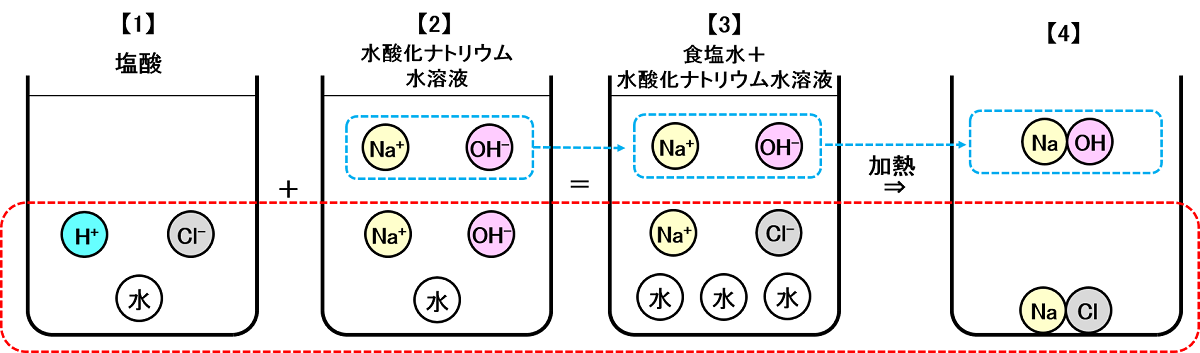
【1】の塩酸は、水に塩化水素(HCl)が1つ溶けたもので、中に含まれる物質は「H2O(水)」「H+(水素イオン)」「Cl-(塩素イオン)」です。
【2】の水酸化ナトリウム水溶液は、水に水酸化ナトリウム(NaOH)が2つ溶けたもので、中に含まれる物質は「H2O(水)」「Na+(ナトリウムイオン)×2」「OH-(水酸化物イオン)×2」です。
2つの水溶液を混ぜると、赤点線部分は<図1>と同じ反応がおこります。最初と異なるのは青点線部分で、「Na+(ナトリウムイオン)」「OH-(水酸化物イオン)」が1つずつ余っている点です。つまり混ぜ合わせた水溶液は、「食塩水+水酸化ナトリウム水溶液」です【3】。
混ぜ合わせた水溶液にはアルカリ性を示す「OH-(水酸化物イオン)」が1つ存在するので、液性はアルカリ性です【3】。
この水溶液を熱して水を蒸発させると、中にあった「Na+(ナトリウムイオン)」と「Cl-(塩素イオン)」は化合して「NaCl(塩化ナトリウム=食塩)となり、白い固体が残ります【4】。
余った「Na+(ナトリウムイオン)」と「OH-(水酸化物イオン)」は固体の「水酸化ナトリウム(NaOH)」となり、食塩とともに白い固体として残ります【4】。
まとめ
ここまで塩酸と水酸化ナトリウム水溶液を例に、中和について解説をしました。ポイントをまとめると次のようになります。
◎ 塩酸と水酸化ナトリウム水溶液を混ぜあわせて中性になると、水を蒸発させて食塩(白い固体)が残ります。
◎ 酸性になった場合も、食塩(白い固体)が残ります。
◎ アルカリ性になった場合は、食塩と水酸化ナトリウム(ともに白い固体)が残ります。
中和とは、「酸性の水溶液とアルカリ性の水溶液を混ぜることによって、水と塩(えん)ができる化学反応」です。中和によって、中性になるとは限らないので注意しましょう。混ぜ合わせた水溶液の液性によって、「アルカリ性」、「中性」、「酸性」のいずれかになります。このことをしっかりと理解したうえで、計算問題に移りましょう。
※記事の内容は執筆時点のものです
とじる
お気に入り機能は
会員の方のみご利用できます
会員登録のうえログインすると
お気に入り保存できるようになります。
お気に入りのコンテンツは、
マイページから確認できます

